常见金属
|
关注钠、铝、铁、铜等金属及其重要化合物在生产、生活中的应用实例,通过对钠、铝、铁、铜等金属及其重要化合物性质的实验探究,增强学习化学的兴趣,发展科学探究能力 |
B |
|
Ⅲ |
|
了解钠、铝、铁、铜等金属及其重要化合物的主要物理性质 |
B |
|
|
|
了解钠、铝、铁、铜等金属分别与氧气、水、酸、碱、盐等物质反应的情况 |
B |
|
|
|
了解氧化钠、氧化铝、氧化铁、氧化铜等金属氧化物分别与水、酸、碱等物质反应的情况 |
B |
|
|
|
了解氢氧化铝的两性 了解氢氧化铝、氢氧化铁、氢氧化铜的受热分解 |
B |
|
|
|
比较碳酸钠、碳酸氢钠的溶解性、热稳定性、与酸的反应 |
B |
|
|
|
初步学会鉴别碳酸钠和碳酸氢钠的方法 |
D |
b |
|
|
了解Fe3+的氧化性,认识Fe3+和Fe2+之间的相互转化 |
B |
|
|
|
了解钠、钾的焰色反应 |
B |
|
|
|
能列举钢、铝合金等合金材料的重要应用 |
A |
|
Ⅰ |
|
通过对钠、铝、铁、铜及其化合物之间转化关系的比较和归纳,体会学习元素化合物知识的一般方法 |
B |
|
Ⅱ |
一、钠
1、钠的物理性质:
银白色、有金属光泽的固体,热、电的良导体,质
软、密度小、熔点低
2、钠与水反应的现象及解释:
①浮:(说明钠的密度比水的密度
小)
②熔:(说明钠的熔点
低 该反应为放热反应)
③游:(说明有气体
H2产生)
④响:(说明有气体产生)
⑤红:溶液中滴入酚酞显红色 (说明生成的溶液
碱性)
3、钠与水反应的化学方程式为
2Na+2H2O=2NaOH+H2↑
离子方程式为
2Na+2H2O=2Na+ +2OH-+H2↑
4、与氧气反应:4Na+O
2==2Na
2O 2Na+O
2=点燃=Na
2O
2
5、4Na+TiCl
4== 4NaCl + Ti
6、Na的用途
①制取纳的重要化合物
②作为中子反应堆的热交换剂
③冶炼Ti.铌锆钒等金属
④钠光源
7、碳酸钠与碳酸氢钠的比较
|
名称 |
碳酸钠 |
碳酸氢钠 |
|
化学式 |
Na2CO3 |
NaHCO3 |
|
俗名 |
纯碱 苏打 |
小苏打 |
|
颜色、状态 |
|
|
|
溶解性 |
|
溶解度比碳酸钠小 |
|
热稳定性 |
——— |
2NaHCO3== Na2CO3 +H2O+CO2↑ |
|
与盐酸反应 |
Na2CO3+2HCl==2NaCl+H2O+CO2↑ |
比Na2CO3剧烈NaHCO3+HCl==NaCl+H2O+CO2↑ |
|
与NaOH反应 |
——— |
NaHCO3+NaOH==Na CO3+H2O |
|
相互转化 |
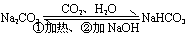 |
8、除杂
Na
2CO
3固体(NaHCO
3)
加热
Na
2CO
3溶液(NaHCO
3)
NaOH
9、鉴别碳酸钠和碳酸氢钠的方法:
加热出现气体是碳酸氢钠或着
加酸先出现气体的是碳酸氢钠,
后出现气体的是碳酸钠
10、转化关系
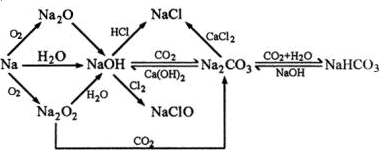
二、铝
1、铝是地壳中最多的金属元素,主要是以化合态存在,铝土矿主要成分是
Al2O3
2、铝的物理性质:银白色金属固体,密度2.70g/cm
3,较强的韧性、延展性,良好的导热导电性
3、化学性质:铝是比较活泼的金属,具有较强的还原性
①与氧气反应
常温下与空气中的氧气反应生成坚固的氧化膜,所以铝有良好的抗腐蚀能力
4Al+3O2====2Al2O3
②铝与冷水不反应,与热水缓慢反应
2Al2O3+6H2O=====2Al(OH)3↓
一般情况下 铝表面的氧化膜阻止了与水的反应
③与非氧化性酸反应
2Al+6HCl==2AlCl3+3H2↑
2Al+3H2SO4==Al2(SO4)3+3H2↑
常温下铝与浓硫酸浓硝酸
钝化
④与强碱反应
2Al + 2 NaOH + 2H
2O===2NaAlO2+3H
2↑
⑤铝热反应
2Al+ Fe2O3===2 Fe + Al 2O3 (焊接铁轨)
4、Al
2O
3为两性氧化物
①与硫酸反应
Al2O3+3H2SO4==Al2(SO4)3+3H2O
②与氢氧化钠
Al2O3+2NaOH==2NaAlO2+H2O
离子方程式
Al2O3+2OH-==2AlO2-+H2O
5、Al(OH)
3两性氢氧化物
①与盐酸反应
Al(OH)3+3HCl==3AlCl3+3H2O
②与烧碱反应
Al(OH)3+NaOH==NaAlO2+2H2O
离子反应:
Al(OH)3+OH-==AlO2-+2H2O
③受热分解
2Al(OH)3== Al2O3+3H2O
6、将NaOH滴加入AlCl
3溶液中至过量现象:先有白色沉淀后沉淀消失
7、实验室常用铝盐与足量氨水制取Al(OH)
3
8、明矾:十二水合硫酸铝钾[KAl(SO4)
2·12H
2O] 易溶于水,溶于水后显
酸性,是因为
Al3++3H2O==AL(OH)3+3H+,因此明矾常用作净水剂,是因为铝离子水解生成氢氧化铝、而氢氧化铝具有
吸附性,吸收了
水中悬浮物而下沉
9、转化关系
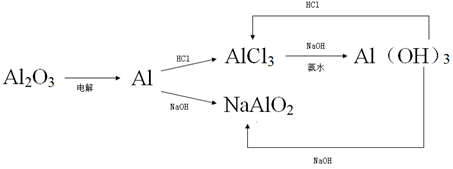
三、铁
1、金属铁
铁的物理性质:有
金属光泽的银白色金属,质软,有良好的
导电、
导热性,具有
延展性,能被磁铁吸引
化学性质
①与非金属反应
2Fe+3Cl2==2FeCl3 ,
Fe+S  FeS
FeS 与纯氧反应
3Fe+2O2  Fe3O4
Fe3O4
②与水蒸气反应
3Fe+4H2O(g)  Fe3O4+4H2(g)
Fe3O4+4H2(g)
③与非氧化性酸反应
Fe+H2SO4== FeSO4+ H2↑ Fe+2HCl== FeCl2+ H2↑
④与盐反应
Fe+CuSO4==FeSO4+Cu 2FeCl3+Fe ═3FeCl2
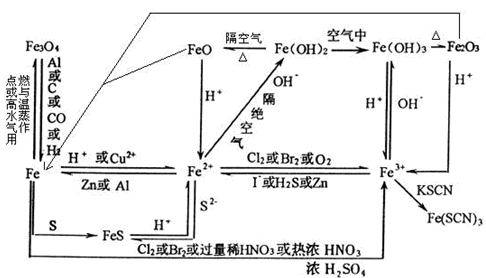
2、铁的重要化合物转化关系
Fe的氧化物:
Fe2O3 俗名
铁红
与HCl反应:
Fe2O3+6H+=2Fe3++3H2O
Fe的两种氢氧化物
|
|
Fe(OH)2 |
Fe(OH)3 |
|
颜色 |
白 → 灰绿 → 红褐色 |
|
化学性质 |
① 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 |
|
②Fe(OH)2+2H+=Fe2++2H2O |
Fe(OH)3+3H+=Fe3++3H2O |
|
|
|
|
|
Fe
2+和Fe
3+鉴别
|
|
Fe2+ |
Fe3+ |
|
水溶液颜色 |
浅绿色 |
黄色 |
|
加入NaOH |
Fe2++2OH—==Fe(OH)2↓
4Fe(OH)2+O2+2H2O== 4Fe(OH)3
白→灰绿→红褐色 |
Fe3++3OH—==Fe(OH)3↓
红褐色 |
|
加入KSCN |
无现象 |
Fe3++3SCN—=Fe(SCN)3
血红色 |
|
通入Cl2 |
2Fe2++Cl2=2Fe3++2Cl— |
|
4、Fe
2+和Fe
3+相互转化:
FeCl
2溶液跟Cl
2反应:
2FeCl2+Cl2══2FeCl3 2Fe2++Cl2=2Fe3++2Cl-
FeCl
3溶液中加入铁粉:
2FeCl3+Fe ═3FeCl2 2Fe3+ + Fe ═ 3Fe2+
5、转化关系
四、合金
1、定义:合金是由两种或两种以上的
金属(或
金属与非金属)熔合而成的具有金属特性的物质
2、特点:
合金硬度一般比它的各成分金属
大,熔点一般比它的各成分金属
低 合金的物理化学机械性能优于各成分金属
3、常见合金
铜合金:
青铜(铜锡、我国最早的合金)、
黄铜(铜锌)、
白铜(铜镍)
铁合金:
生铁(铁、碳,含碳2%~4.3%)
钢:
碳素钢(低碳钢C <0.3%、中碳钢C 0.3%~0.6%、高碳钢 C>0.6%)
合金钢(具有各种不同的优良性能,用于制不锈钢及各种特种钢)
铝合金:密度小,强度大,用于飞机汽车火箭船舶制造
钛合金:密度小,强度大,耐高温,耐腐蚀等优点,主要用于飞机、火箭、导弹、人造卫星、宇宙飞船等尖端领域




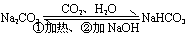



 FeS 与纯氧反应3Fe+2O2
FeS 与纯氧反应3Fe+2O2  Fe3O4
Fe3O4 Fe3O4+4H2(g)
Fe3O4+4H2(g) 
