
设为首页
手机版
 |
|||
设为首页
|
|||
手机版 |
|||
最 新 公 告 |

非金属及其化合物
| 了解氯、氮、硫、硅等非金属及其重要化合物的主要物理性质 | B | ||
| 了解氯气的氧化性(与氢气、钠、铁、某些盐等的反应)及其与水、碱的反应 | B | ||
| 知道氯水的消毒和漂白原理 | A | ||
| 了解硫的可燃性和氮气的稳定性 | B | ||
| 知道硅元素在自然界中以SiO2及硅酸盐的形式存在,知道晶体硅是良好的半导体材料 | A | ||
| 知道氯、氮、硫、硅等非金属单质的主要用途 | A | Ⅰ | |
| 了解二氧化硫与氧气、与水的反应,认识亚硫酸的不稳定性,认识二氧化硫漂白作用与次氯酸漂白作用的区别 了解二氧化氮与水的反应,了解二氧化硅与氢氟酸、与碱性氧化物、与强碱的反应 | B | ||
| 了解氨气与水、与酸的反应 了解氨水的成分以及氨水的不稳定性 了解铵盐易溶于水、受热易分解、与碱反应等性质 | B | ||
| 了解次氯酸、浓硫酸、硝酸的强氧化性 了解浓硫酸、硝酸分别与铜、C木炭的反应 了解常温下铁、铝在浓硫酸、浓硝酸中的钝化现象 | B | ||
| 了解陶瓷、玻璃、水泥等硅酸盐产品的用途 | B | Ⅰ | |
| 了解氮循环对生态平衡的重要作用 了解氮氧化物、二氧化硫等污染物的来源、性质和危害 认识非金属及其重要化合物在生产中的应用和对生态环境的影响,逐步形成可持续发展的思想 | B | Ⅱ | |
| 通过对氯、氮、硫、硅等非金属及其重要化合物的有关知识进行归纳与整理,体会学习元素化合物知识的一般方法 | C | Ⅱ |
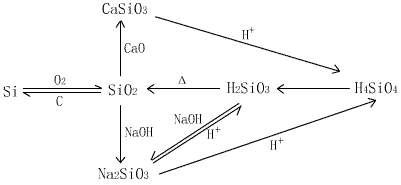
| 物质 | 硅 | 二氧化硅 |
| 存在形式 | 自然界中均是化合态,可制成晶体硅和无定形硅 | 硅石﹑石英﹑玛瑙﹑硅藻土 |
| 结构 | 每个硅形成四对共用电子对的空间网状结构 (类示于金刚石) | 每个硅连接四个氧,每个氧连接两个硅,形成空间网状结构 |
| 物理性质 | 高熔﹑沸点高﹑硬度大﹑有金属光泽的灰黑色固体,良好的半导体 | 高熔沸点﹑硬度大﹑难溶于水 |
| 化学性质 |
a 常温下除氟气﹑氢氟酸和强碱外与其他物质都不反应 Si + 2F2 = SiF4 Si+ 4HF = SiF4↑ + 2H2↑ Si+2NaOH+2H2O=Na2SiO3+2H2↑ b 一定条件下与氧气﹑氯气等反应 Si + O2  SiO2 SiO2Si + 2Cl2  SiCl4 SiCl4 |
a 常温下除氢氟酸和强碱外,其他都不反应 SiO2+4HF=SiF4↑+2H2O (刻蚀玻璃) SiO2+2NaOH =Na2SiO3+ H2O (盛放碱性溶液的试剂瓶只能用橡胶塞) b高温下二氧化硅在与金属氧化物反应 SiO2 + CaO  CaSiO3 CaSiO3 |
| 用途 | 制半导体材料 | 制耐火材料,如坩埚 制作饰品 如水晶项链﹑石英表等 光导纤维等 |
| 硅酸盐材料 | 玻璃 | 水泥 | 陶瓷 |
| 原料 | 纯碱,石灰石,石英 | 黏土,石灰石,石膏(调节水泥凝结时间) | 黏土 |
| 设备 | 玻璃窑 | 水泥回转窑 | \ |
| 反应 |
SiO2+CaCO3  CaSiO3+CO2↑ CaSiO3+CO2↑SiO2+Na2CO3  Na2SiO3+CO2↑ Na2SiO3+CO2↑ |
复杂的物理、化学变化 | \ |
| 成分 | Na2SiO3﹑CaSiO3﹑SiO2 | 3CaO·SiO2, 2CaO·SiO2, 3CaO·Al2O3 | 硅酸盐 |
 2NaCl 2Fe+3Cl2
2NaCl 2Fe+3Cl2  2FeCl3 Cu+Cl2
2FeCl3 Cu+Cl2  CuCl2
CuCl2  2HCl
2HCl MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O SO2
SO2 H2SO3 2SO2 + O2
H2SO3 2SO2 + O2  2SO3
2SO3 CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O CO2↑+ 2SO2↑+ 2H2O
CO2↑+ 2SO2↑+ 2H2O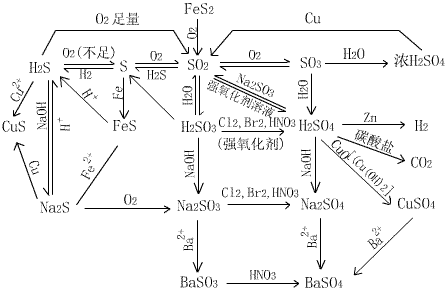
|
放电
〓〓 |
 NH3·H2O NH3 + HCl = NH4Cl
NH3·H2O NH3 + HCl = NH4Cl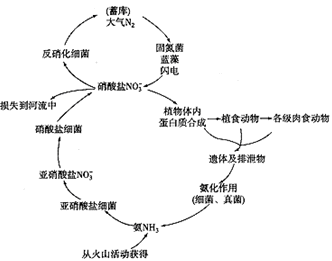

|
||
苏州进步网辅导中心保证家教教学质量,按提分收费!
家教热线:18936084829(胡老师),0512—66790309。